La investigación clínica de nuevos medicamentos en fases tempranas, que implican una mayor complejidad y son los que permiten el acceso de los pacientes a los nuevos tratamientos de forma temprana, ha experimentado un importante avance en España en los últimos años, hasta representar hoy más de la mitad de los ensayos clínicos que se llevan a cabo en el país. Este avance ha permitido impulsar también los ensayos clínicos en fases iniciales en dos áreas fundamentales: la pediatría y las enfermedades raras.
En concreto, el compromiso conjunto de los profesionales sanitarios y los investigadores, las administraciones sanitarias, los gestores hospitalarios y la industria farmacéutica ha hecho posible un avance sin precedentes en materia de investigación clínica en fases tempranas de patologías pediátricas y enfermedades poco frecuentes.
Así lo explicó este miércoles la responsable de la Plataforma de Medicamentos Innovadores de Farmaindustria, Amelia Martín Uranga, durante su intervención en el Hospital Universitario La Paz de Madrid en la IV Jornada sobre Ensayos Clínicos en Fase I en España, organizada por la Fundación Teófilo Hernando.
Para seguir avanzando en este terreno, Farmaindustria está trabajando ya en la cuarta actualización de la Guía de Unidades de Fases Tempranas, que por primera vez será en formato online y permitirá una mayor interactividad y mejores criterios de búsqueda de los recursos necesarios para poner en marcha este tipo de ensayos.
Impulso en pediatría
En el caso de los ensayos clínicos en pediatría, que ascendieron a 119 en 2018 según los datos del Registro Español de Ensayos Clínicos (REEC), el 44,5% (un total de 53) son ya de fases tempranas, frente al 36,8% de 2015.
En el caso de los impulsados directamente por la industria, el 32,3% de los ensayos en pediatría corresponde a la fase II, mientras que en el 15,4% de los casos se trata de ensayos en fase I, según los datos del Proyecto BEST de excelencia en investigación clínica. “Estos datos reflejan además una tendencia muy positiva a lo largo de los años que refleja hasta qué punto la pediatría figura ya entre las prioridades de investigación de la industria farmacéutica”, destacó Martín Uranga.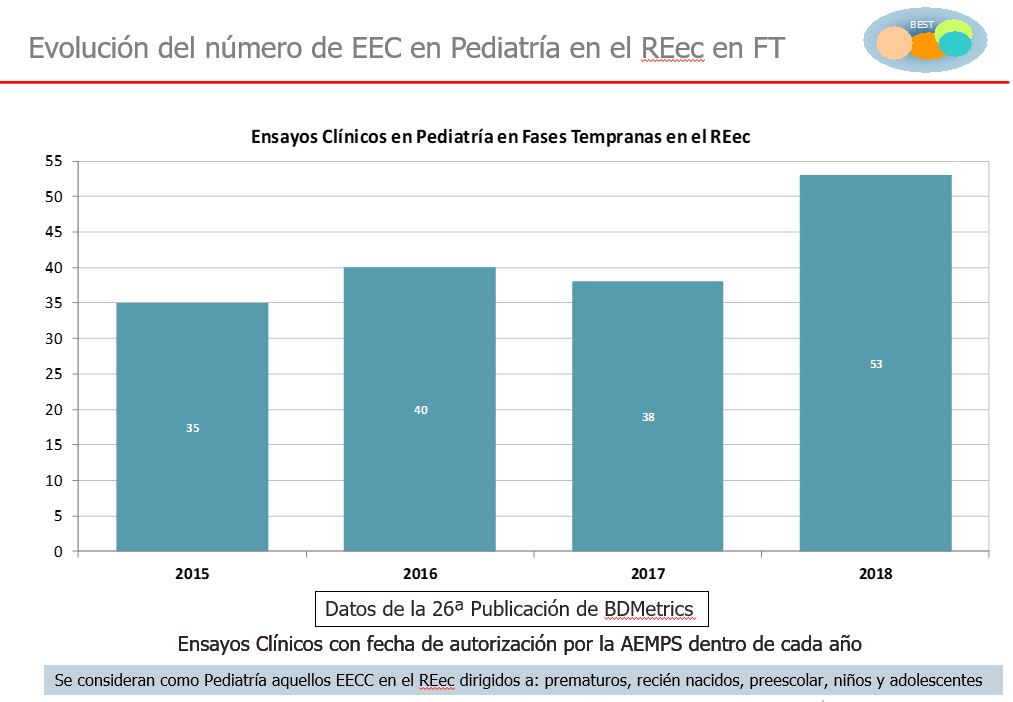 Fruto también de este interés fue la publicación, en septiembre de 2017, de la Guía de Unidades de Investigación Clínica en Pediatría, que nació con el objetivo de fomentar el trabajo en red y la puesta en marcha de unidades específicas en los hospitales para desarrollar ensayos clínicos de nuevos medicamentos en niños, que resultan esenciales para validar de forma adecuada las indicaciones y dosis de los tratamientos dirigidos a la población pediátrica.
Fruto también de este interés fue la publicación, en septiembre de 2017, de la Guía de Unidades de Investigación Clínica en Pediatría, que nació con el objetivo de fomentar el trabajo en red y la puesta en marcha de unidades específicas en los hospitales para desarrollar ensayos clínicos de nuevos medicamentos en niños, que resultan esenciales para validar de forma adecuada las indicaciones y dosis de los tratamientos dirigidos a la población pediátrica.
También con este propósito Farmaindustria colabora con otras entidades, como la Asociación Española de Pediatría y los hospitales universitarios Sant Joan de Déu de Barcelona y Niño Jesús de Madrid, entre otros, en el fomento de iniciativas en materia de investigación clínica en pediatría. Asimismo, respaldó la creación de la Red Española de Ensayos Clínicos Pediátricos (RECLIP), que representa a España en la Red Europea de Ensayos Clínicos Pediátricos y con la que sigue colaborando.
Más investigación temprana en enfermedades raras
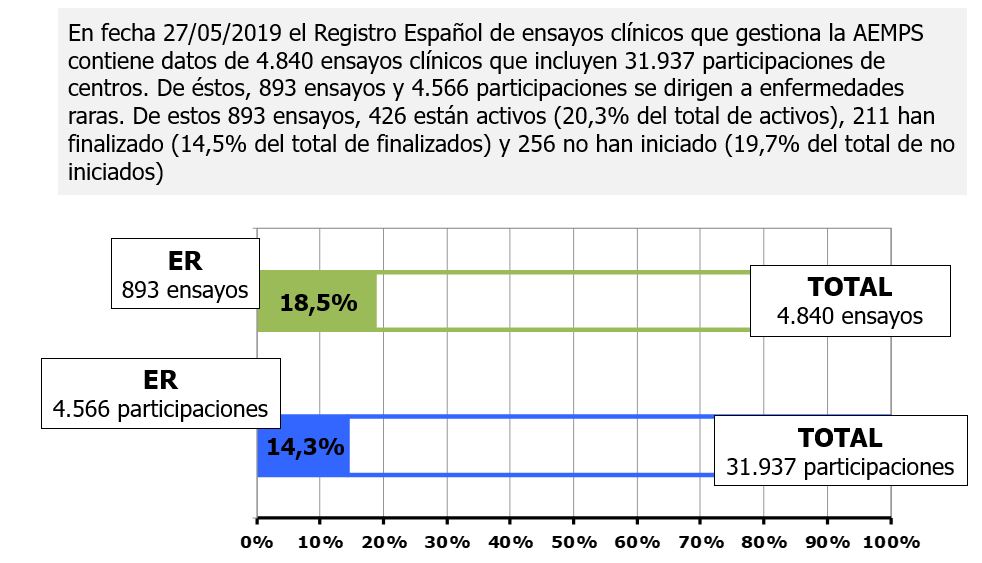
La misma tendencia positiva se viene registrando, en los últimos tiempos, en el ámbito de las enfermedades raras. Tal como detalló la responsable de la Plataforma de Medicamentos Innovadores de Farmaindustria, 893 de los 4.840 ensayos clínicos incluidos en el REEC (a fecha 27 de mayo), esto es, el 18,5% del total, se centran en enfermedades raras. Si se contemplan los últimos años (2015-2018), el 20,4% de estos ensayos clínicos en enfermedades raras corresponden a las fases tempranas (I y II).
 Asimismo, y según datos recogidos por el Proyecto BEST, desde 2015 la industria farmacéutica ha impulsado un total de 448 ensayos clínicos sobre enfermedades raras en fases tempranas, de los que 84 corresponden a ensayos de medicamentos huérfanos que han contado con la participación de más de 1.500 pacientes en España. En el caso de estos ensayos, la hematología (49,5% de las participaciones de centros) y la oncología (36,7%) han sido las áreas terapéuticas de mayor interés.
Asimismo, y según datos recogidos por el Proyecto BEST, desde 2015 la industria farmacéutica ha impulsado un total de 448 ensayos clínicos sobre enfermedades raras en fases tempranas, de los que 84 corresponden a ensayos de medicamentos huérfanos que han contado con la participación de más de 1.500 pacientes en España. En el caso de estos ensayos, la hematología (49,5% de las participaciones de centros) y la oncología (36,7%) han sido las áreas terapéuticas de mayor interés.
Para avanzar en este ámbito resulta crucial la colaboración público-privada a través de proyectos como los puestos en marcha por la Iniciativa europea de Medicamentos Innovadores (IMI), pero también la creciente participación de los pacientes en todo el proceso de I+D de los nuevos medicamentos, algo en lo que están ya implicadas las compañías tanto de forma individual como a través de Farmaindustria y Efpia, la asociación que representa a la industria farmacéutica en Europa.
“Todos estos datos indican que, gracias al esfuerzo de los distintos agentes implicados, España se puede considerar ya un país excelente en materia de investigación clínica en fases tempranas, ya que tiene una buena red de unidades, y cuenta con científicos y médicos de primer nivel, así como con el compromiso de pacientes e industria, sin olvidar que las infraestructuras y los equipos están ya adaptándose a los nuevos diseños de ensayos clínicos, como los basket trials, los multi-arms trials o los digital trials”, destacó Martín Uranga.
“Sigue habiendo margen de mejora en aspectos como el fomento de la participación de pacientes, la eliminación de barreras administrativas, la mejora de las infraestructuras hospitalarias más allá de los grandes centros de referencia o la formación de personal especializado, pero desde luego el país está avanzando por el camino correcto, hasta el punto de estar en condiciones de convertirse en uno de los líderes mundiales en investigación clínica en los próximos años”, concluyó.
 | Innovamos para las personas
| Innovamos para las personas




