La innovación biomédica y el compromiso de las compañías farmacéuticas con la investigación de nuevos medicamentos no se detiene tras el histórico esfuerzo realizado en la lucha frente a la pandemia de la Covid-19. Así lo muestra el último informe EFPIA Pipeline Innovation Review, realizado por la consultora Iqvia para la Federación Europea de la Industria Farmacéutica (Efpia). El estudio muestra que actualmente hay más de 8.000 medicamentos en investigación, el 10% de ellos específicos para enfermedades raras o poco frecuentes. De estas moléculas que las compañías farmacéuticas tienen en fase de desarrollo clínico en todo el mundo, casi el 70% son las primeras de su serie (first-in-class), es decir, que abren nuevos caminos y que son la mejor prueba del compromiso de este sector con la innovación y la salud de las personas.
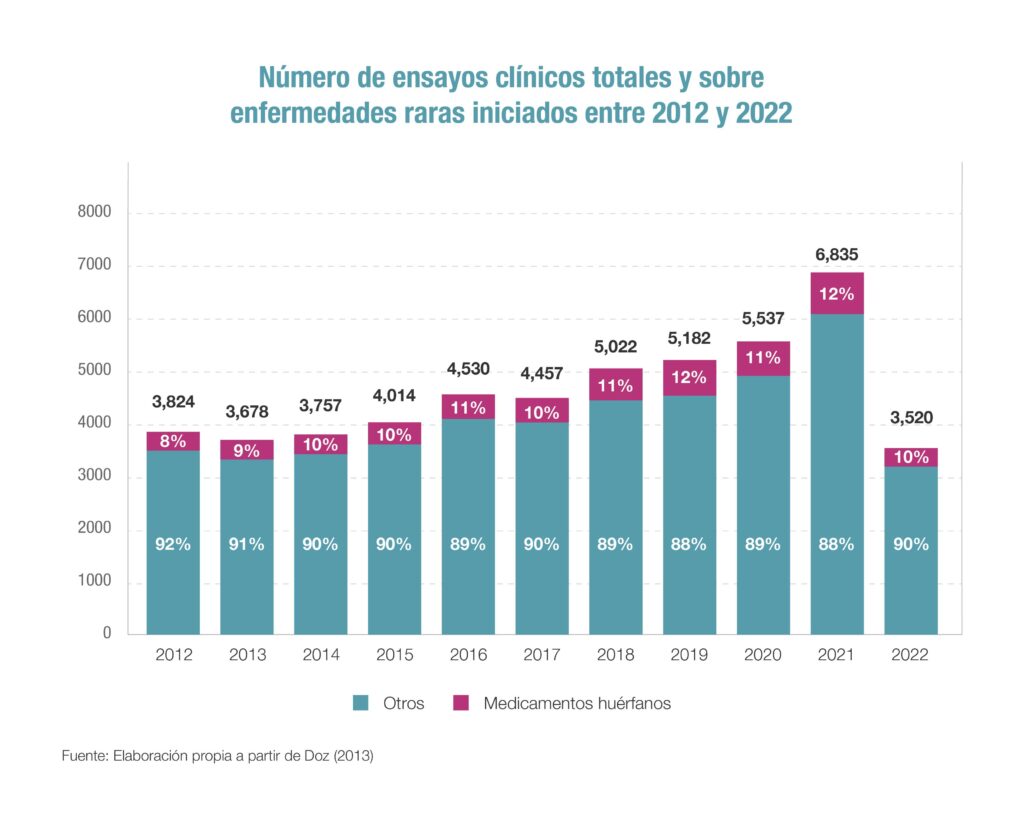
En concreto, el informe indica que en 2021 se pusieron en marcha en todo el mundo un total de 6.835 ensayos clínicos, una cifra histórica que supone casi un 20% más que la cifra de ensayos del año 2020 (5.537) y más de un 50% superior a los ensayos clínicos de sólo cuatro años antes, en 2017, cuando se iniciaron 4.457 ensayos en todo el mundo. En este año 2022, la cifra de ensayos clínicos sigue al alza y hasta el mes de agosto se habían iniciado un total de 3.520 ensayos.
“Estas cifras son un indicador claro de una industria farmacéutica a la vanguardia de la ciencia, una industria que continúa invirtiendo fuertemente en encontrar nuevos tratamientos para cientos de afecciones médicas. Detrás de cada dato del informe hay una historia de esperanza para los pacientes, para sus familias y para los profesionales médicos”, asegura Nathalie Moll, directora general de Efpia.
En los últimos cinco años -de 2017 a 2022-, cinco áreas terapéuticas han centrado buena parte de las investigaciones de nuevos medicamentos. Son oncología (24% del total de ensayos); enfermedades infecciosas (12% del total), neurología (10%), hematología (8%) y endocrinología (6%). Además, el informe pone de manifiesto la decidida apuesta que la industria farmacéutica viene desempeñando en la investigación de nuevos medicamentos frente a las enfermedades raras en los últimos años. Así, en la última década (ver gráfico), se ha observado un aumento constante del número de ensayos clínicos para estas patologías y de manera continua ya representan entre el 10% y el 12% del total.
Europa pierde el paso en I+D biomédica
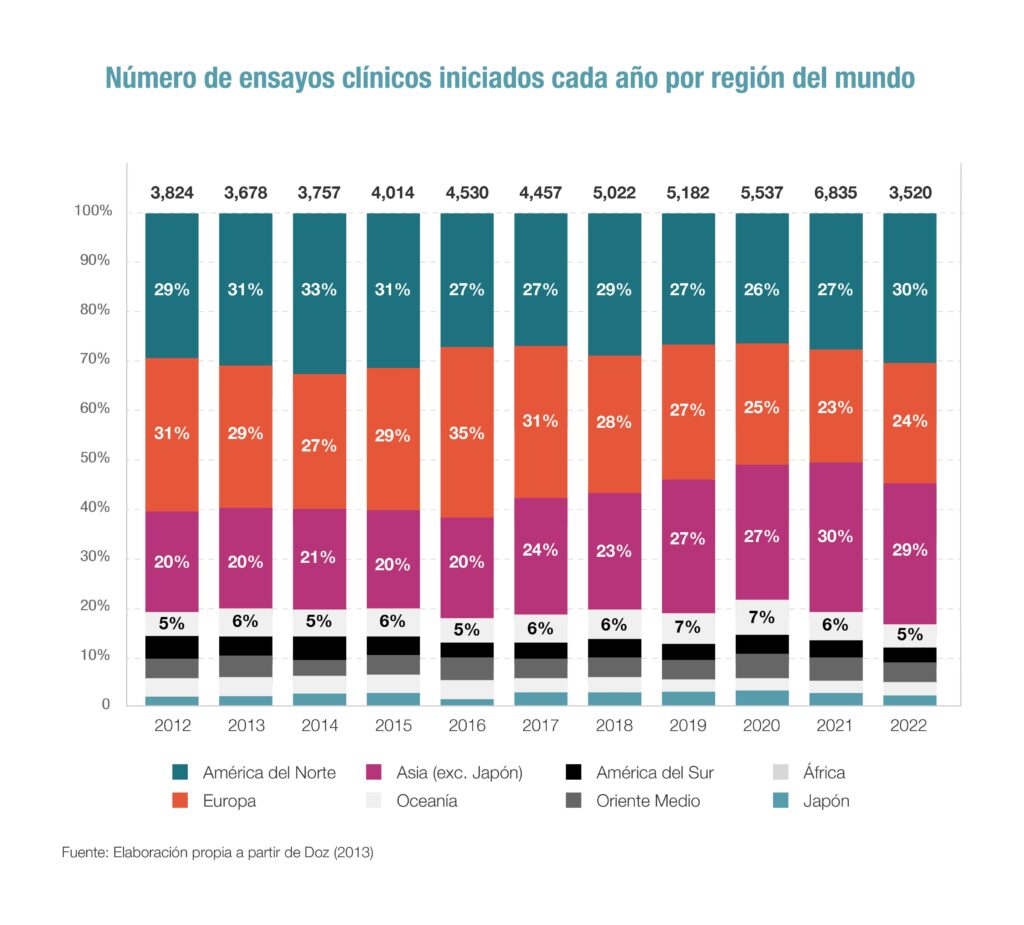
El informe de Iqvia también pone el foco en el lugar de origen de la investigación. Y en este punto se confirma el retroceso que se está viviendo en Europa en el terreno de la I+D biomédica, frente a Estados Unidos y los nuevos países emergentes. Así, los últimos datos muestran que, del total de ensayos clínicos iniciados en 2021, hasta el 30% se pusieron en marcha en países de Asia, mientras que Estados Unidos fue la segunda región, con el 27% y Europa ocupa ya el tercer lugar, con el 23% del total de los ensayos. La tendencia a largo plazo observada es el aumento de la proporción de ensayos clínicos realizados en Asia (principalmente China y Corea del Sur), que ha crecido más del 10% en la última década, indica el informe.
Hay que recordar que a principios de los años 90 Europa era la región líder -por encima de Estados Unidos y Japón- en inversión en I+D de nuevos medicamentos. “Si bien nuestra industria invierte alrededor de 41.500 millones de euros al año en investigación y desarrollo en Europa, y un mayor porcentaje de los ingresos dedicados a I+D que cualquier otro sector basado en la investigación, la inversión global en investigación biomédica se ha dirigido cada vez más a otros lugares y Europa se enfrenta a la creciente competencia de países emergentes, como Brasil, China, Corea o India, que están aumentando su inversión en investigación biomédica”, señala Moll, que apunta a la futura Estrategia Farmacéutica Europea como una oportunidad para cambiar el rumbo.
Se ha dado ya algún paso relevante que ayudará a gestiones en futuras pandemias y desarrollo de medicamentos para diferentes enfermedades. Así, con el propósito de reforzar el marco europeo de ensayos clínicos, a la vez que mantener un alto nivel de protección de los participantes, la solidez de los datos y la transparencia, se inició en enero de 2022 la iniciativa ACT EU, o Aceleración de los Ensayos Clínicos en la UE. Este proyecto liderado por la Comisión Europea, la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) y la Red de Jefes de Agencias de Medicamentos (HMA, por sus siglas en inglés) cuenta con una participación activa de la Agencia Española de Medicamentos y Productos Sanitarios (Aemps) en su plan de trabajo para transformar la manera en la que se inician, diseñan y desarrollan los ensayos clínicos.
Sin embargo, como apunta la directora general de la Efpia, “lo que importa ahora son las reglas y políticas que fomentan la inversión, como un ecosistema de derechos de propiedad intelectual sólido y predecible y un marco regulatorio de vanguardia -sostiene-. Si no somos capaces de implementarlos en Europa, la brecha entre nosotros y el resto del mundo seguirá ampliándose y Europa desperdiciará su oportunidad de convertirse en líder en salud y ciencias de la vida”.
 | Innovamos para las personas
| Innovamos para las personas