El cáncer de mama es uno de los ejemplos más claros del impacto que tienen los avances en la investigación biomédica. La medicina de precisión y los tratamientos dirigidos han contribuido a estratificar mejor a las pacientes y a desarrollar paneles genómicos que permiten diferenciar qué personas se benefician de las distintas terapias y cuáles no. Esto ha tenido una repercusión directa en los avances en los índices de supervivencia y en la mejora de la calidad de vida de las pacientes.
No obstante, hay que seguir trabajando para implantar de forma generalizada test genómicos, biomarcadores moleculares y diagnóstico por imagen en toda la cartera del Sistema Nacional de Salud (SNS) para conseguir el despliegue en profundidad de la medicina de precisión, creando infraestructuras y protocolos de coordinación para análisis genómicos y trabajando en red y equipos multidisciplinares, tanto en investigación como en asistencia.
Así lo defendió la directora asociada de Investigación Clínica y Traslacional de Farmaindustria, Amelia Martín Uranga, en el XI Encuentro de la Federación Española de Cáncer de Mama (Fecma), dedicado a los Nuevos desafíos de la investigación y la innovación ante el cáncer de mama en todas sus fases y celebrado este viernes en la Universidad Internacional Menéndez Pelayo, en Santander.
Arguyó que estos importantes avances son el reflejo del compromiso de la industria farmacéutica innovadora con este tipo de tumores. En el periodo 2016-2021, el Registro Español de Estudios Clínicos (REEC) indica que hay en marcha en nuestro país 225 ensayos clínicos para cáncer de mama, de los cuales el 53% (119) ya son para cáncer de mama metastásico (cuando el tumor se disemina por otros órganos del cuerpo y cuando se encuentra en una etapa más avanzada).
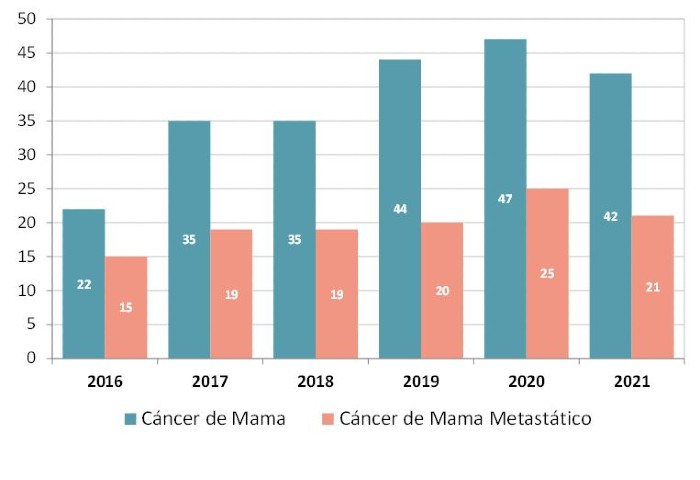
Número de ensayos clínicos para cáncer de mama y, dentro de éstos, para el tipo metastásico en el periodo 2016-2021 (REEC).
“Las compañías farmacéuticas promueven el 73% de los ensayos en cáncer de mama y el 78% de los estudios para el tipo metastásico. En ambos casos, cerca del 70% se corresponden con las fases I y II de la investigación clínica, las más complejas, fruto de la reducción de los tiempos de puesta en marcha de los proyectos y muestra del salto de calidad que ha dado España en estos últimos años, con más de 40 unidades específicas en estas fases”, explicó.
Para seguir mejorando, Martín Uranga puso el foco en la necesidad de potenciar la colaboración público-privada, tanto en investigación preclínica y traslacional como clínica, que se ha revelado como el modelo más exitoso de funcionamiento en I+D de nuevos medicamentos, tal y como ha constatado el hallazgo de respuestas a la pandemia por coronavirus.
Asimismo -añadió-, la digitalización, el big data, la inteligencia artificial y el uso de los datos en vida real supondrán un cambio de paradigma para la investigación biomédica, lo que exigirá, entre otras medidas, infraestructuras adecuadas y personal formado; incorporar otras áreas y perfiles hasta ahora no partícipes de la investigación (data science); interoperabilidad de historias clínicas, o la implementación tecnológica adecuada para poder realizar los nuevos procedimientos de monitorización.
Ensayos clínicos con todas las garantías para los pacientes
En paralelo a estos avances, la industria farmacéutica trabaja para garantizar la seguridad de los datos de los pacientes. Martín Uranga citó como ejemplo el nuevo Código de Conducta regulador del tratamiento de datos personales en el ámbito de los ensayos clínicos y otras investigaciones clínicas y de la farmacovigilancia, impulsado por Farmaindustria y pionero en Europa.
En esta línea, la portavoz de Farmaindustria destacó la importancia de la participación de los pacientes en los ensayos desde el inicio del proceso investigador hasta su culminación, por el valor real que tienen sus aportaciones para seguir avanzando en la medicina del futuro. También insistió en la necesidad de explicar a los pacientes el valor de la reutilización de datos para hacer más eficientes los procesos de I+D con garantías en la protección de los datos personales. Y se refirió a la nueva propuesta de reglamento para la creación del Espacio Europeo de Datos Sanitarios, que pone también el acento en los segundos usos de los datos para la investigación y lo que puede significar para avanzar en investigación biomédica.
A esto hay que sumar, recordó, la aplicación del reglamento europeo sobre ensayos clínicos, “que busca ganar en transparencia, simplificar procedimientos y agilizar los tiempos, para armonizar el proceso en Europa. Esto aumentará la competencia y exige que España se dote de infraestructuras y personal especializado en la gestión y ejecución de los ensayos clínicos para afianzar su liderazgo en esta materia”. De hecho, a partir del 31 de enero de 2023 todos los ensayos clínicos que se pongan en marcha deberán presentarse a través del portal europeo habilitado para esta actividad.
Los mensajes esperanzadores que ofrece esta realidad en ensayos clínicos en cáncer de mama podrían verse ensombrecidos por el deterioro en los indicadores de acceso a la innovación que existen en nuestro país. Así, por ejemplo, en los últimos dos años, de las siete nuevas opciones de tratamiento para el cáncer de mama metastásico sólo una ha sido financiada por el SNS, y con restricciones en la indicación. Es crítico que todo este esfuerzo en investigación se traduzca en que las pacientes tengan un acceso rápido a los avances que se vayan produciendo, puesto que cada día cuenta.
Martín Uranga compartió coloquio con Silvia Antolín, oncóloga del Complejo Hospitalario Universitario de La Coruña; Ana Casas, especialista en Oncología Clínica y presidenta de la Fundación Actitud frente al Cáncer; Eva Gómez Salinas, representante de la Asociación de Mujeres Afectadas de Cáncer de Mama de Requena, Valencia (Amacma); Llanos Sánchez Serrano, moderadora y representante de la Asociación de Mujeres Afectadas de Cáncer de Mama (AMAC) de Albacete; y la representante de la Asociación Navarra de Cáncer de Mama Saray Pamplona.
 | Innovamos para las personas
| Innovamos para las personas




