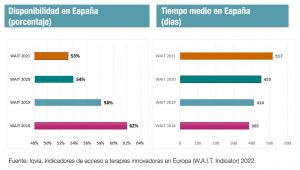
El problema del acceso de los pacientes españoles a los nuevos medicamentos se agrava: si bien nos situamos algo por encima de la media de 40 países europeos, nuestro sistema público de salud dispone de menos nuevos fármacos que los países de referencia en Europa y los incorpora más tarde. Según el informe anual Indicadores de acceso a terapias innovadoras en Europa (W.A.I.T. Indicator), elaborado por la consultora Iqvia para la Federación Europea de Asociaciones de la Industria Farmacéutica (Efpia), que se ha hecho público hoy y que analiza las autorizaciones entre 2017 y 2020, el tiempo medio que transcurre desde que un nuevo medicamento es aprobado por las autoridades europeas hasta que está disponible para su uso en España a finales de 2021 es ya de 517 días, más de 17 meses de demora. Y el retraso aumenta: al finalizar 2020 era de 453 días.
Los datos constatan además que el tiempo de aprobación de los nuevos medicamentos en España sigue siendo superior al de los países de referencia en Europa. Así, en Alemania la espera es de 133 días; en Francia, de 240 días; en Inglaterra, de 340, y en Italia, de 429.
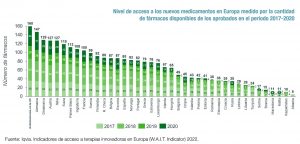
El otro gran indicador que mide el estudio es la disponibilidad, es decir, el número de nuevos medicamentos que son incluidos en la financiación pública y puestos a disposición de los pacientes. El porcentaje de fármacos disponibles en España es también el más bajo de los grandes mercados europeos. Según el informe, a 1 de enero de 2022 sólo estaban disponibles en España 85 de los 160 fármacos aprobados en la Unión Europea en el periodo 2017-2020, es decir, el 53%. Mientras, en Alemania este porcentaje es del 92%; en Italia, del 79%; en Inglaterra, del 68%, y en Francia, del 66%. Desde el año 2018, el porcentaje de disponibilidad en España ha disminuido en nueve puntos porcentuales.
Según el informe, España tiene también el mayor porcentaje de disponibilidad restringida, con un 41%. Es decir, del 53% de los medicamentos disponibles sobre el total de autorizados en Europa, cuatro de cada diez lo están en nuestro país con algún tipo de restricción en su uso. Ese porcentaje es del 1% en Alemania, del 13% en Italia, del 15% en Francia y del 39% en Inglaterra.
Preocupación en los medicamentos oncológicos y huérfanos
La demora en la aprobación y la disponibilidad en España de los medicamentos autorizados en Europa tiene también su reflejo en áreas de especial gravedad para los pacientes, como son la Oncología y los llamados medicamentos huérfanos, los destinados a tratar las enfermedades raras o poco frecuentes, áreas donde en los últimos meses han proliferado las demandas de solución por parte de sociedades científicas y organizaciones de pacientes.
En España, según el citado informe, el tiempo medio en 2021 para acceder a los nuevos medicamentos oncológicos ha aumentado en 74 días respecto a 2018, y la demora ya alcanza los 469 días. Además, el porcentaje de disponibilidad de los tratamientos oncológicos aprobados en Europa entre 2017 y 2020 es en España del 61% (están disponibles 25 de los 41 fármacos oncológicos autorizados en este periodo), y es la cifra más baja de los países de nuestro entorno. Así, la disponibilidad en Alemania es del 100%; en Italia, del 90%; en Inglaterra, del 85%, y en Francia, del 80%.
En el caso de los medicamentos huérfanos, el tiempo medio en 2021 para el acceso en España ha aumentado en 184 días respecto al informe de 2018 y se sitúa en los 696 días, lo que supone casi dos años de retraso. Además, sólo el 44% (25 de 57) de estos tratamientos autorizados en Europa en los últimos cuatro años están disponibles en España. Es el porcentaje más bajo de los países de referencia: Alemania tiene el 95%; Italia, el 75%; Francia, el 72%, e Inglaterra, el 61%.
Un modelo más ágil y eficiente
Para tratar de acortar estos tiempos y equiparar de hecho las oportunidades de los pacientes españoles con las de sus vecinos europeos, Farmaindustria viene proponiendo una serie de mejoras en el procedimiento actual de evaluación y fijación de precios y financiación pública de medicamentos en nuestro país. El objetivo es establecer un modelo que sea ágil, predecible y eficiente, de manera que ayude a solucionar con urgencia el problema actual.
Este modelo debe basarse en la cooperación entre la Administración y las compañías farmacéuticas, para articular un diálogo más temprano con vistas a ganar en agilidad, y en una mayor participación de expertos clínicos y asociaciones de pacientes en el proceso de evaluación y financiación de los medicamentos.
“Como muestran estos datos, tenemos un problema estructural en el procedimiento de evaluación y financiación, que no es tan ágil como el de los países con los que debemos compararnos”, explica Humberto Arnés, director general de Farmaindustria. “España -añade- debe aspirar a estar entre los países que mejor acceso proporcionan a los nuevos tratamientos, porque contribuyen a aumentar la supervivencia y la calidad de vida de muchas personas. Es responsabilidad de todos poner estos tratamientos a disposición de los profesionales sanitarios en el plazo más corto posible para que puedan beneficiarse los pacientes. Por eso, desde Farmaindustria abogamos por trabajar junto con el Ministerio de Sanidad para conseguir este objetivo común y superar con un procedimiento más eficiente los cuellos de botella en la aprobación de medicamentos en nuestro país”.
 | Innovamos para las personas
| Innovamos para las personas