Farmaindustria actualiza su ‘Guía de Investigación Clínica en Fases Tempranas’ para responder a las necesidades de investigadores, pacientes y compañías
Responsables de estas unidades defienden la capacidad de nuestro país para desarrollar y atraer estos ensayos clínicos en sus etapas iniciales

noviembre 2021
España es un referente mundial en ensayos clínicos. Para muchas compañías farmacéuticas es ya el segundo país del mundo -sólo por detrás de Estados Unidos- en esta actividad, paso indispensable en la creación de nuevos medicamentos. Durante la pandemia de coronavirus ha quedado constatado: España ha sido el primer país de Europa y el cuarto del mundo en número de ensayos clínicos contra el coronavirus.
Este protagonismo español es fruto de años de colaboración estrecha entre industria farmacéutica, Administración, sistema y profesionales sanitarios y pacientes, y también consecuencia del esfuerzo creciente de las compañías farmacéuticas en investigación clínica, que invierten actualmente 713,5 millones de euros al año en este ámbito sólo en nuestro país, un 60% del total de la inversión en I+D, que en 2019 alcanzó la cifra récord de 1.211 millones de euros.
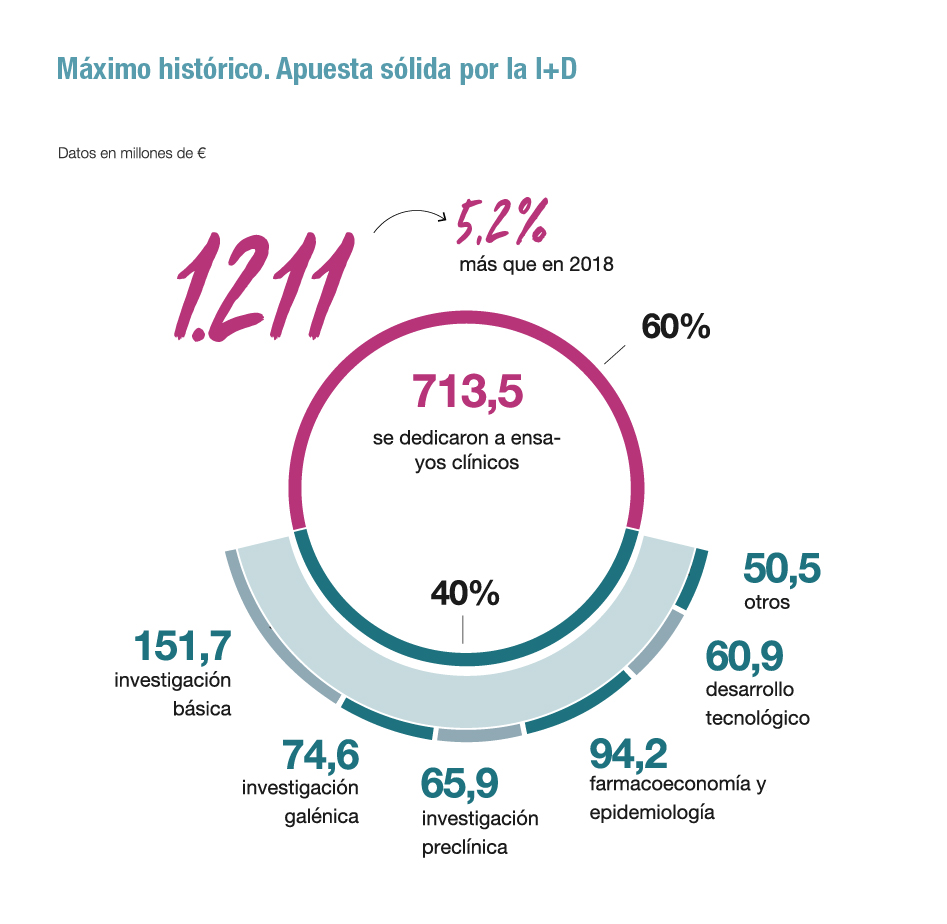
En este sentido, España parte en estos momentos con una ventaja competitiva frente a otros países para apuntalar su liderazgo en ensayos clínicos e incluso para promover un ecosistema de investigación biomédica que impulse también la investigación básica y preclínica y atraer así mayor inversión internacional en un momento de revolución en este campo, de la mano de la medicina de precisión y las terapias avanzadas.
El esfuerzo ha arrojado grandes resultados, pero no es el momento de detenerse. Existen desafíos y campos de mejora en el desarrollo de nuevos medicamentos en los que las compañías farmacéuticas ya están trabajando.
Es el caso de la investigación clínica temprana, lo que se conoce como fases I y fases II de los ensayos clínicos, que son las que requieren un mayor nivel de complejidad científica y hacen posible a su vez el acceso de los pacientes a las nuevas terapias de forma más prematura.
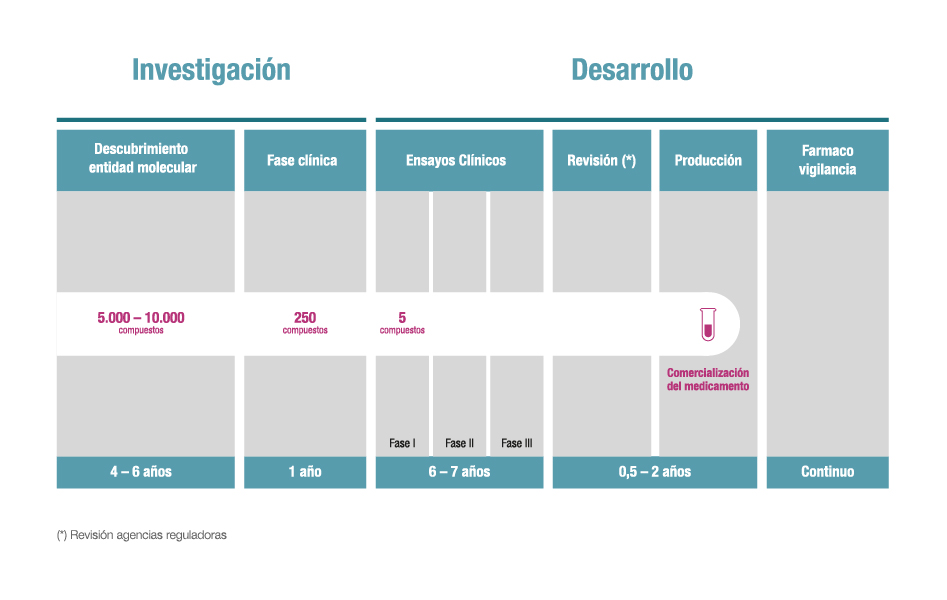
Para avanzar en este terreno, Farmaindustria -a través de su Plataforma Tecnológica de Medicamentos Innovadores– ha lanzado este año una nueva actualización de la Guía de Investigación Clínica en Fases Tempranas, que, ya en su cuarta edición, constituye un modelo mejorado que facilita la búsqueda tanto a investigadores y pacientes como a compañías farmacéuticas de los centros de referencia que existen en España para la investigación en dichas fases tempranas.
“Entre los objetivos que se busca alcanzar con la nueva guía destaca, por supuesto, el de servir de estímulo a la realización de estudios de fases tempranas. En esta ocasión, se ha decidido mejorar su operatividad mediante la creación de una aplicación web que facilite tanto su edición como la futura exportación y visualización de datos para responder a las necesidades de la industria con respecto a los nuevos diseños de ensayos clínicos, el nivel científico y los requisitos regulatorios”, explica Amelia Martín Uranga, directora asociada de Investigación Clínica y Traslacional de Farmaindustria.
38 unidades en 11 comunidades autónomas
La actual versión se ha realizado con la colaboración de 38 Unidades de Fases Tempranas dentro del marco del proyecto BEST, una iniciativa impulsada por la industria farmacéutica y en el que se integran todos los agentes públicos y privados para crear una Plataforma de Excelencia en Investigación Clínica de Medicamentos en España. Asimismo, la guía cuenta con 8 secciones principales para cada unidad: información general; calidad, acreditaciones, auditoría e inspecciones; instalaciones y recursos innovadores; personal; sujetos del ensayo clínico; evaluación farmacodinámica y farmacocinética; experiencia y actividad, y métricas. Con toda esta información se consigue una visión completa del trabajo de cada unidad. Asimismo, se prevé que antes de que acabe 2021 se incorpore la información de nuevas unidades recientemente inauguradas en nuestro país.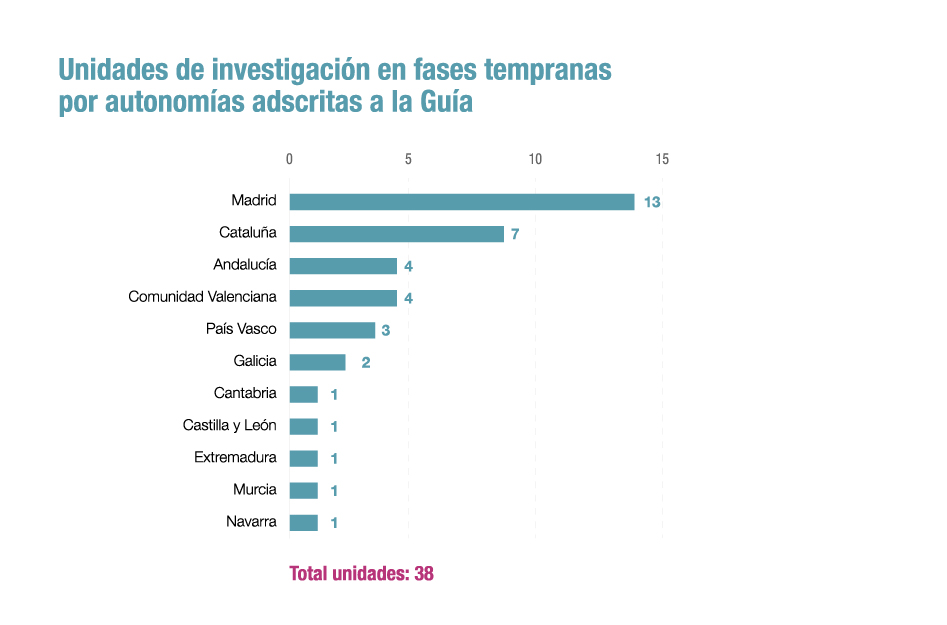
“Hoy, más del 50% de los ensayos clínicos impulsados por la industria farmacéutica en España corresponden a las fases tempranas de la investigación. Este tipo de ensayos han aumentado en un 41% desde 2004 en nuestro país, pero tenemos que seguir mejorando estas cifras en pro de nuestros pacientes. El trabajo que desarrollan estas unidades supone, en muchos casos, una esperanza para muchos pacientes para los que no existe alternativa terapéutica, al tiempo que significa tratarles con los fármacos del futuro, si finalmente son autorizados años después”, explica Martín Uranga.

permiten conocer con detalle su trabajo gracias a la actualización de esta guía
La guía nace refrendada por investigadores de centros que participan en ella, dando un gran valor a esta nueva herramienta en múltiples sentidos. En primer lugar, porque la investigación biomédica es cada vez más colaborativa e internacional. “Hoy en día, el diseño de nuevos fármacos tiene un componente muy personalizado, es decir, de un gran esfuerzo en la selección de las poblaciones correctas para facilitar una mejora de los resultados. Una selección más estricta de los pacientes y un desarrollo más racional de los medicamentos exige un trabajo en red. Cada vez más, los ensayos en fase I dejan de ser una iniciativa de hospitales aislados, y en ese sentido conocer los recursos que tienen otros hospitales es una herramienta esencial”, explica Ander Urruticoechea, director científico de Onkologikoa, centro oncológico en San Sebastián.
“Tener una lista de expertos en cada campo permite una sinergia entre grupos y unidades que mejorará la calidad de la investigación”, refrenda Olga Laosa, farmacóloga clínica e investigadora de la Unidad de Ensayos Clínicos del Centro de Investigación Clínica del Anciano (CICA) del Instituto de Investigación Sanitaria Hospital Universitario de Getafe (IISGetafe).
“Para realizar estudios académicos multicéntricos, el hecho de conocer otras instituciones que tienen unidades de fase I o de fases tempranas para población pediátrica es muy útil para nosotros. No son tantos los centros que desarrollan investigación pediátrica y esta guía nos da información de dónde poder hacer este ensayo clínico”, añade Joana Claverol, coordinadora de la Unidad de Investigación Clínica del Hospital Sant Joan de Déu de Barcelona.
En segundo lugar, la guía refrenda la capacidad que tiene España para realizar este tipo de ensayos y, por consiguiente, la posibilidad de atraer más estudios e inversión a nuestro país. “Tener una guía que aglutine todas las unidades de fase I, de entrada, demuestra la capacidad del país para realizar estas fases tempranas. Sin duda, es un paso adelante para romper la estadística de que el 60% de esta investigación se esté desarrollando en Estados Unidos”, valora Claverol.
En palabras de Rafael López López, líder del Grupo de Oncología Médica Traslacional (Oncomet) del Instituto de Investigación Sanitaria de Santiago de Compostela, es un instrumento que posiciona las unidades de fases tempranas a nivel nacional e internacional, “atrayendo a los promotores e incrementando, por tanto, el número de ensayos que se realizan en nuestro centro. Asimismo, favorece las colaboraciones entre unidades, lo que permite una mejora continua de las mismas”.
Visibilidad y calidad para la investigación en fases tempranas
De hecho, defienden los investigadores consultados, la Guía de Unidades de Investigación Clínica en Fases Tempranas supone también un plus de calidad y visibilidad para esta investigación. “Es una gran carta de presentación para las unidades que se dedican a este tipo de estudios. Resultará de mucha utilidad para dar visibilidad de cara a los distintos promotores y CRO (Contract Research Organizations, empresas que colaboran con las compañías farmacéuticas en la realización de ensayos clínicos) y ayudará a los profesionales sanitarios a encontrar centros en todo el territorio nacional donde poder derivar pacientes que quieran ser considerados para estos ensayos”, subraya Víctor Moreno, director de la Unidad de Investigación Clínica en Fase I del Hospital Fundación Jiménez Díaz, de Madrid.
Urruticoechea considera que es un instrumento de comunicación “en un área donde antes no la había, pues dependía mucho de las redes personales. Es una manera de dar oficialidad y calidad a una guía de conocimiento de fases clínicas, saber de ellas, saber en qué están focalizadas para así ayudar tanto a los investigadores a poner recursos a disposición de los pacientes como a los propios pacientes, que cada vez más acuden a las consultas con su búsqueda hecha respecto a la posibilidad de entrar en ensayos tanto en fases avanzadas como en fases tempranas”. “En nuestro caso -apostilla-, redundará en sumar calidad a la atención oncológica, que en nuestro país ya está entre las más excelentes del mundo”.
“La guía arroja una foto de la calidad que hay detrás del trabajo de estos centros, porque para estar en ella tienes que cumplir unos requisitos y al resto de instituciones nos da mucha seguridad. De esta guía también esperamos que nos dé más visibilidad. Un ejemplo de esto es que nosotros, hace años, pusimos en marcha un Comité de Bioseguridad a raíz de un estudio en fase I para una terapia génica y en este tiempo hemos recibido muchas consultas sobre cómo lo hemos hecho, qué personas conforman dicho comité, qué PNT (protocolos normalizados de trabajo) tenemos… Y nosotros estamos encantados de compartir dicha información y de aprender de los demás, porque nos da posibilidad de crecimiento y de hacer las cosas mejor”, relata la responsable de investigación del Hospital Sant Joan de Déu de Barcelona.
En la misma línea se pronuncia Alberto Borobia, coordinador de la Unidad de Ensayos Clínicos del Hospital La Paz (Madrid): “Con esta nueva actualización esperamos que se dé una mayor visibilidad a las unidades de fase I en función de su experiencia y de las áreas de trabajo en la que desarrolla ensayos clínicos. Es importante potenciar el desarrollo de fases tempranas en nuestro país en unidades acreditadas y con experiencia”. “Además -añade-, facilitará atraer investigación en fases tempranas a nuestras unidades de ensayos clínicos, permitiendo una mejor selección por parte de la industria farmacéutica de los centros en los que poder realizar este tipo de estudios”.

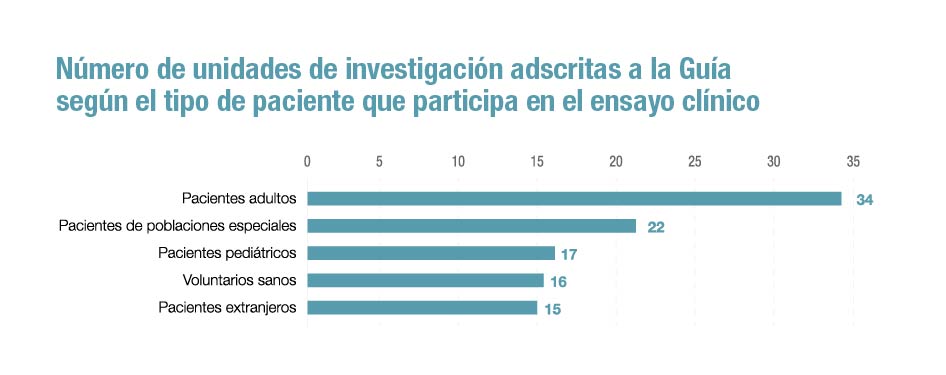
desarrollan ensayos clínicos para niños y adolescentes
Los mayores beneficiados, los pacientes
Pero si hay una ventaja destacada de esta guía es la oportunidad que supone para los pacientes, especialmente en el caso de poblaciones con necesidades específicas, como pueden ser los niños y adolescentes -en el documento hay 17 unidades registradas- o los ancianos. “El impulso en la realización de ensayos clínicos de fases tempranas facilitará el acceso a nuevos medicamentos a pacientes que no disponen de alternativas, mejorando en definitiva su calidad de vida”, celebra López López.
“La actualización de esta guía esperamos que conciencie a la industria farmacéutica, a los investigadores y a las agencias reguladoras de la necesidad de incluir a la población anciana en los ensayos clínicos. La realización de estudios enfocados a población anciana, con objetivos, criterios de selección y procedimientos adaptados a ellos, mejorará la calidad de la prescripción y el cumplimiento terapéutico. Asimismo, la realización de investigación en condiciones reales de uso, con la población que finalmente se beneficiará de estos tratamientos, mejorará la evidencia evitando que se produzcan problemas de seguridad tras la comercialización”, afirma Laosa.
“Gracias a los ensayos precoces los pacientes tienen mayores posibilidades terapéuticas. Aunque históricamente se entendía que este tipo de ensayos no tenían un beneficio clínico elevado, en la actualidad se ha visto gracias al desarrollo de la inmunoterapia y la terapia dirigida que las tasas de respuesta pueden llegar hasta el 20%”, cifra Moreno. Y añade: “Para nosotros este tipo de esfuerzo resulta de vital importancia. Gracias a la información que contiene esta guía, los investigadores podemos crear conciencia en la población, tanto de médicos y pacientes como de promotores, de la capacidad de la que disponen las distintas unidades de ensayos clínicos precoces de España. En la actualidad, yo diría que estamos en la cabeza de la investigación clínica en Europa, y este tipo de guías ayudan a destacar esto y crear proyección internacional”.
Los ensayos clínicos son una pieza crítica en la innovación terapéutica y representan una oportunidad única para los pacientes, puesto que pueden tener acceso a un tratamiento en investigación que puede ser la última oportunidad para muchos; para los profesionales sanitarios, que participan de la investigación más puntera, y para la calidad de la prestación sanitaria y del Sistema Nacional de Salud, puesto que todo ese conocimiento investigador se puede aplicar a la labor asistencial. Cualquier paso adelante que se dé en este sentido, coinciden todos los expertos, redundará en un gran beneficio para la sociedad.
Reconocimiento a la nueva guía
Precisamente estos días, la Guía de Unidades de Investigación Clínica en Fases Tempranas ha recibido el Premio E-nnova Health 2021, en la categoría de Transformación Digital, en la que se engloban todas aquellas iniciativas y proyectos que han destinado sus esfuerzos en la transformación digital, con especial consideración en aquellos que se han realizado de forma colaborativa, como es este caso.
Los Premios E-nnova Health, que nacen con el fin de identificar y reconocer iniciativas digitales en salud que aporten valor, contribuyan a la sostenibilidad del sistema y mejoren la calidad de vida del paciente, son un proyecto de los medios especializados en salud Diario Médico y Correo Farmacéutico, ambos pertenecientes al grupo Unidad Editorial.
“Este premio supone un reconocimiento a la utilidad de esta guía y también un aliciente para seguir desarrollando proyectos con esta doble naturaleza de impulsar la investigación biomédica en España y también de avanzar en la digitalización en salud, que está llamada a ser un gran catalizador de este sector”, valora Amelia Martín Uranga.
